2024年10月,权威学术期刊《Cancer Cell》发表了一篇题为“Distinct Tumor Architectures and Microenvironments in the Initiation of Breast Cancer Metastasis to the Brain”的研究论文。该研究的核心目标是深入探究乳腺癌脑转移的早期阶段特征,特别聚焦于三阴性乳腺癌(TNBC)与HER2阳性乳腺癌(HER2BC)这两种类型的脑转移特性,以期揭示它们在不同肿瘤结构和微环境背景下的转移启动机制。

(文章标题截图)
研究背景
乳腺癌是全球女性中最常见的癌症类型之一,同时也是导致患者死亡的主要原因之一,其中脑转移扮演着至关重要的角色。尽管在乳腺癌的治疗领域已经取得了显著的进步,但脑转移的治疗仍然面临巨大的挑战,是当前难以攻克的难题之一。以往的研究大多聚焦于乳腺癌细胞如何适应脑部的微环境以及它们与脑内细胞的相互作用机制,然而,对于脑转移早期阶段的具体过程和机制,我们的了解仍然相对有限,这限制了我们对乳腺癌脑转移的有效预防和治疗策略的开发。
研究设计
该研究综合运用了小鼠模型与人类组织样本,对三阴性乳腺癌(TNBC)和HER2阳性乳腺癌(HER2BC)这两种乳腺癌类型在脑转移的早期阶段进行了深入的探索。研究团队细致观察了这两种肿瘤类型在脑部定植过程中的行为,并发现它们倾向于形成各具特色的肿瘤结构和基质界面。为了深入理解这些结构对微环境的影响,研究采用了先进的单细胞转录组学技术,这一技术揭示了这些特定结构如何诱发不同的小胶质细胞反应,并进一步探究了这些免疫反应是如何与肿瘤衍生的细胞外基质(ECM)成分发生相互作用的。此外,研究还详尽描述了具体患者的特征、分组方法以及所采用的研究手段,为后续的严谨数据分析奠定了坚实的基础,确保了研究结果的可靠性和科学性。
研究结果
研究结果显示,在三阴性乳腺癌(TNBC)模型中,肿瘤倾向于形成与星形胶质细胞和微胶质细胞广泛接触的血管周围鞘状结构;而在HER2阳性乳腺癌(HER2BC)模型中,肿瘤则更倾向于形成由自身产生的Tenascin C所驱动的紧凑球状体,这种结构将基质细胞隔离在外围区域。通过单细胞转录组学的深入分析,研究揭示了这些特定的肿瘤结构如何诱导出不同的阿尔茨海默病相关小胶质细胞(DAM)反应,并参与了GAS6受体AXL的激活过程。
尤为关键的是,研究进一步发现,乳腺癌细胞衍生的Tenascin C不仅驱动了球状体的殖民性生长,还触发了通过I型干扰素反应介导的疾病相关小胶质细胞状态的转变。这些重要发现不仅揭示了乳腺癌脑转移的两种主要亚型在脑殖民策略上的独特性,还深入探讨了小胶质细胞在其中的参与作用以及内在的驱动机制,为理解乳腺癌脑转移的复杂性提供了全新的视角。
1、肿瘤结构与微环境的差异化特征
本研究率先揭示了三阴性乳腺癌(TNBC)与HER2阳性乳腺癌(HER2BC)在脑转移进程中展现出截然不同的肿瘤结构和微环境特征。具体而言,TNBC倾向于形成与血管紧密相连的周围鞘状结构,这种结构往往与星形胶质细胞和微胶质细胞发生混合。相反,HER2BC则倾向于形成紧凑的球状体,这些球状体的形成是由自身分泌的Tenascin C(TNC)所驱动的,并且它们能够有效地将基质细胞隔离在肿瘤组织的外围区域。
在小鼠模型实验中,TNBC模型(包括MDA231-BrM和E0771-BrM)所形成的肿瘤结构明显与星形胶质细胞和微胶质细胞发生广泛的交互与混合。而HER2BC模型(包括HCC1954-BrM和MMTV-ErbB2-BrM)则在肿瘤组织与周围血管之间形成了一道明显的隔离屏障,这一特征限制了肿瘤与血管的直接接触(见图1A-C)。
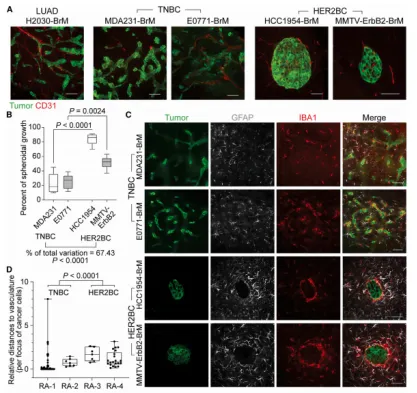
(图1 血管周围和球状脑定殖模式和基质界面)
2、微胶质细胞反应的差异性激活
借助单细胞转录组学的深入分析,本研究进一步揭示了TNBC与HER2BC这两种肿瘤结构能够激活不同类型的小胶质细胞(DAM)反应。在TNBC和HER2BC模型中,小胶质细胞均展现出了与阿尔茨海默病相关的DAM(疾病相关小胶质细胞)特征,但两者在DAM的具体反应阶段上存在差异。具体而言,与TNBC相关的DAM反应主要表现为炎症相关的阶段1 DAM特征,这表明在TNBC模型中,小胶质细胞处于一种早期的炎症反应状态。而相比之下,HER2BC模型中的小胶质细胞则更倾向于发展为具有吞噬功能的阶段2 DAM,这暗示了在HER2BC脑转移过程中,小胶质细胞可能参与了更多的清除和修复过程(见图2D-G)。
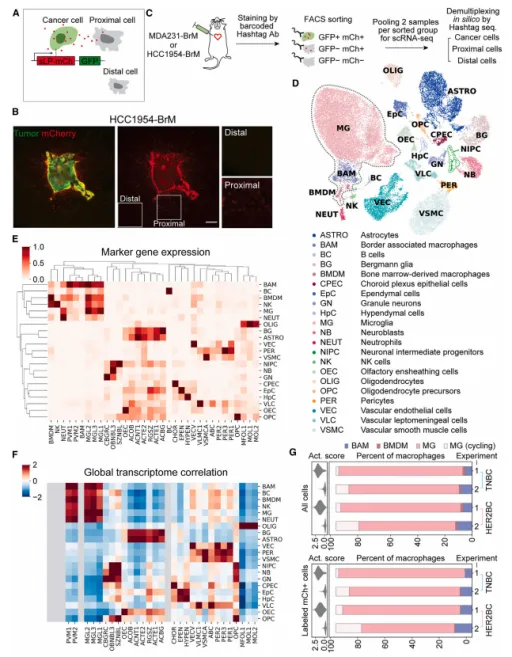
(图2 TME细胞成分)
3、TNC在HER2BC脑转移中的关键作用
研究进一步发现,HER2BC细胞在脑转移过程中展现出更高的细胞外基质(ECM)组分表达水平,特别是Tenascin C(TNC)的表达显著增加。为了验证TNC在HER2BC脑转移中的作用,研究团队通过抑制HER2BC细胞中TNC的表达,观察到肿瘤球状体的形成受到明显抑制,同时脑转移的负担也显著降低(见图5A-F)。这些结果有力地证明,TNC不仅是驱动HER2BC脑转移的内在关键因素,而且也是触发具有吞噬功能的阶段2疾病相关小胶质细胞(DAM)反应的重要因素。
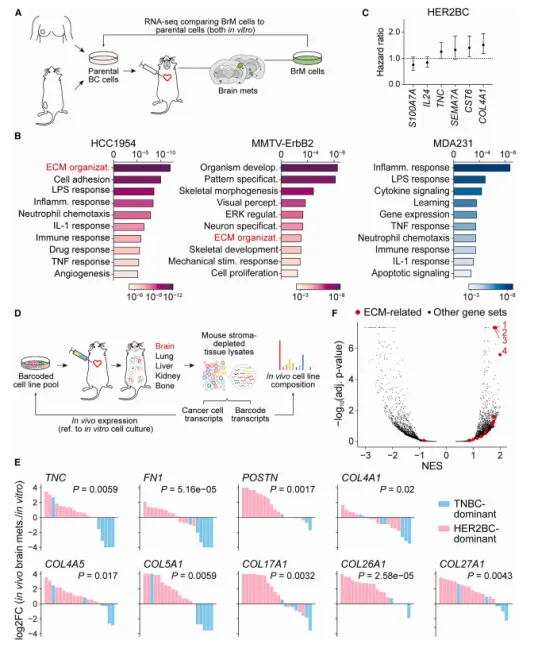
(图3 HER2 BC脑转移瘤ECM成分基因表达增强)
4、GAS6-AXL信号通路的双重作用
此外,本研究还深入探讨了GAS6-AXL信号通路在三阴性乳腺癌(TNBC)和HER2阳性乳腺癌(HER2BC)脑转移过程中所扮演的不同角色。研究结果显示,在TNBC中,GAS6-AXL信号通路的激活促进了肿瘤细胞的生存与增殖,这表明该通路在TNBC脑转移中起到了正向推动作用。然而,在HER2BC中,增强GAS6-AXL信号却可能通过激活微胶质细胞的吞噬功能来发挥抑制肿瘤生长的作用(见图4A-E)。
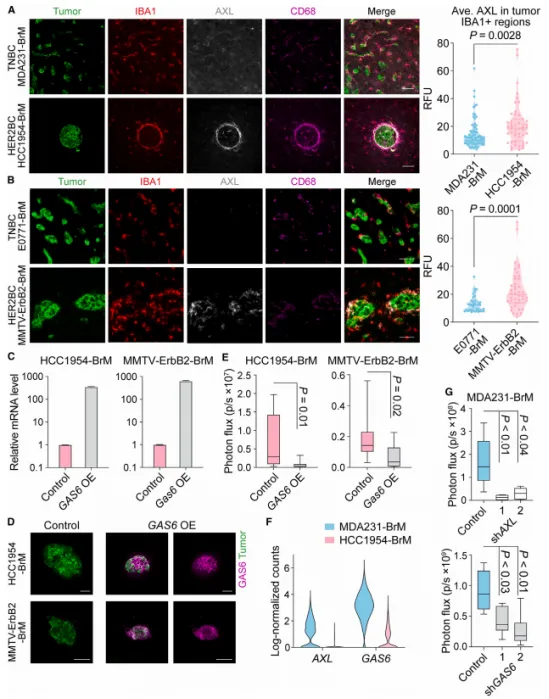
(图4 GAS6-AXL信号在MDA231 TNBC和HCC1954 HER2BC脑转移中的不同作用)
研究小结
本研究的核心结论凸显了肿瘤空间特性在攻克脑转移疾病过程中的关键作用。研究揭示,在三阴性乳腺癌(TNBC)和HER2阳性乳腺癌(HER2BC)的脑转移中,存在两种截然不同的肿瘤结构模式,这一现象在小鼠实验模型及人类临床样本中均得到了验证。这些差异性的结构由独特的肿瘤-细胞外基质(ECM)相互作用、自分泌生长调节机制以及反应性基质细胞的激活所共同驱动。
尤为重要的是,本研究还发现,肿瘤自身产生的Tenascin C不仅作为驱动球状体(或称为肿瘤球体)殖民的内在因素,还扮演着激活第二阶段疾病相关巨噬细胞(DAM)的关键角色。
这些新发现为探索脑转移的早期治疗策略开辟了全新的视角和途径。同时,文中也坦诚地讨论了研究的局限性,并对未来工作的潜在方向进行了展望,旨在为相关领域的研究者提供宝贵的启示和参考。
参考文献
1、GAN S, MACALINAO D G, SHAHOEI S H, et al. Distinct tumor architectures and microenvironments for the initiation of breast cancer metastasis in the brain. Cancer Cell[J]. 2024;42(10):1693-1712.e24. DOI:10.1016/j.ccell.2024.08.015.