在2024年11月,《Cancer Cell》期刊上发表了一篇题为“Long-term Breast Cancer Response to CDK4/6 Inhibition Defined by TP53-Mediated Geroconversion”的研究文章。该研究深入探讨了TP53基因状态对HR+(激素受体阳性)乳腺癌患者接受CDK4/6抑制剂治疗响应的影响。研究揭示了一个重要发现:在p53缺失导致耐药性的情况下,通过联合抑制CDK2可以克服这一难题,从而实现长期疾病控制的新机制。这一发现为开发新的联合治疗方案提供了坚实的理论基础,并有望显著改善患者的治疗预后。

(文章标题截图)
研究背景
乳腺癌是全球女性中最常见的恶性肿瘤类型之一,其中激素受体阳性(HR+)乳腺癌占据了显著的比例。CDK4/6抑制剂作为HR+乳腺癌治疗领域的重要药物,通过作用于细胞周期G1期的关键蛋白,有效减缓了疾病的进展。然而,患者对CDK4/6抑制剂的治疗响应却表现出极大的差异性,有的患者仅能维持几个月的疗效,而有的患者则能持续受益数年之久。
研究设计
本研究是一项基于大规模、具有详细临床注释的队列研究,纳入了共计467名接受一线CDK4/6抑制剂(具体为阿贝西利、帕博西利和哌柏西利)联合内分泌疗法的转移性HR+乳腺癌患者。研究团队利用MSK-IMPACT这一先进的检测平台,对患者的肿瘤样本进行了深入的基因组测序,旨在探究与治疗响应密切相关的基因变异。
根据患者对治疗的不同响应时长,研究将患者划分为短期、中期和长期响应三个组别。随后,采用Firth惩罚逻辑回归分析和弹性网Cox回归模型,系统地分析了这些基因变异与无进展生存期(PFS)之间的潜在关联,以期揭示影响CDK4/6抑制剂疗效的关键因素。
研究结果
研究揭示,TP53基因的缺失(占比27.6%)和MDM2基因的扩增(占比6.4%)与HR+乳腺癌患者缺乏长期疾病控制显著相关。在HR+乳腺癌的模型中,p53的缺失并未直接影响CDK4/6的活性或G1期的阻滞,而是通过激活CDK2,促进了药物不敏感的p130磷酸化过程。这种磷酸化的p130持续存在,有效阻止了DREAM复合体的正常组装,从而使得细胞能够逃逸原有的生长阻滞,重新进入细胞周期,进而促进了肿瘤的进展。
值得注意的是,CDK2抑制剂的引入能够克服p53缺失所带来的不利影响,诱导细胞发生衰老转化,并展现出明显的衰老表型。这一发现表明,要实现HR+乳腺癌的长期治疗响应,完全抑制CDK4/6和CDK2激酶活性似乎是不可或缺的条件。
1、TP53和MDM2基因变异与长期疾病控制的关联
本研究首先针对467名接受一线CDK4/6抑制剂治疗的转移性HR+乳腺癌患者进行了深入分析,结果揭示出TP53基因的缺失(占比达到27.6%)以及MDM2基因的扩增(占比6.4%)与患者缺乏长期疾病控制之间存在显著关联。这一重要发现提示我们,TP53和MDM2的基因状态或许能够作为预测CDK4/6抑制剂治疗效果的关键生物标志物。
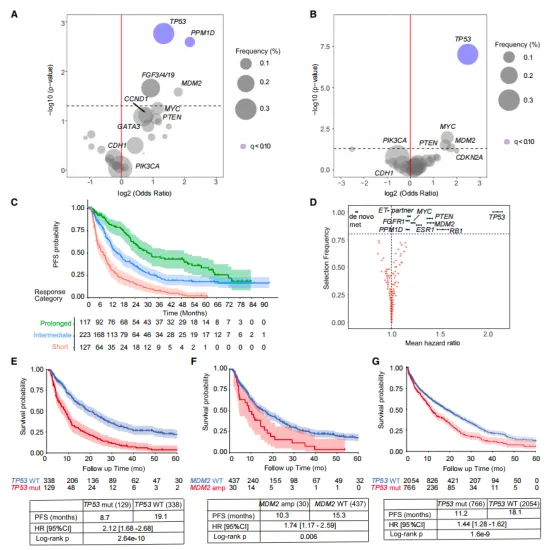
(图1 在未能实现长期对CDK4/6i反应的患者中富集的体细胞变化)
2、TP53缺失对CDK4/6抑制剂反应的影响
研究进一步借助HR+乳腺癌模型,深入探索了p53缺失对CDK4/6抑制剂疗效的具体影响机制。结果表明,p53的缺失并未直接改变CDK4/6的活性或阻碍G1期的阻滞作用,而是通过激活CDK2,促进了药物不敏感的p130蛋白的磷酸化过程。这种磷酸化的p130蛋白持续存在,有效地阻止了DREAM复合体的正常组装,进而使得细胞能够摆脱生长抑制,重新进入细胞周期,加速了肿瘤的恶性进展。
3、CDK2抑制剂的潜在治疗作用
研究中还取得了另一项重要发现:CDK2抑制剂展现出了克服p53缺失所引发的耐药性的能力。它通过促进细胞发生衰老转化(即geroconversion),并诱导出衰老表型的显现,从而实现了对肿瘤生长的长期抑制效果。这一发现强烈暗示,联合抑制CDK4/6和CDK2或许能够成为一种针对TP53突变型HR+乳腺癌的有效治疗手段,同时也有助于抑制药物耐受性的发展,为这类患者的治疗提供了新的潜在策略。
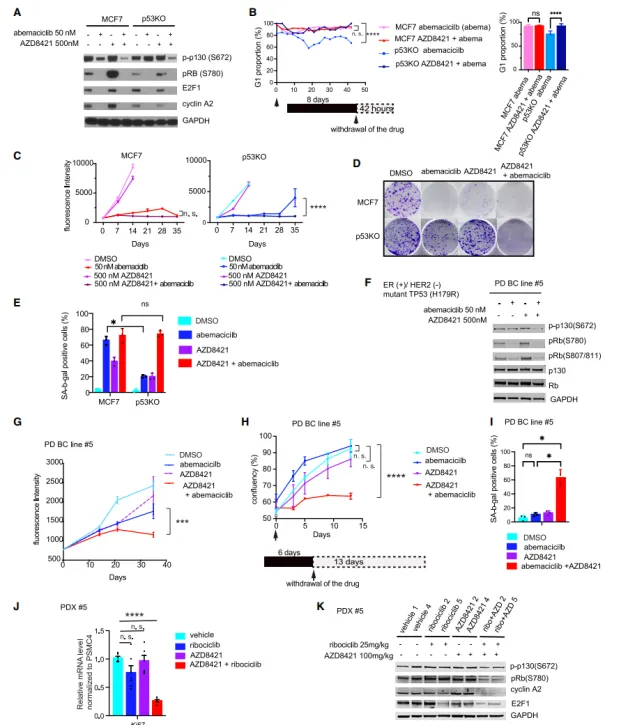
(图2 CDK2和CDK4/6的联合抑制实现持久的肿瘤生长抑制)
4、长期反应与基因组多样性的相关性
研究结果进一步强调,为了在具有基因组多样性的HR+乳腺癌患者中实现持久的治疗反应,完全抑制CDK4/6和CDK2激酶的活动似乎是至关重要的。这一点在图1中得到了直观的体现,该图详细展示了不同基因变异状态与长期疾病控制之间的密切关联,并且通过弹性网Cox回归模型对患者进行了风险分组,进一步揭示了不同基因型患者对于治疗的反应差异及潜在的风险水平。这些发现为制定更加精准和有效的治疗方案提供了重要的科学依据。
5、FELINE试验中TP53状态对治疗反应的影响
在对FELINE 2期临床试验数据的深入分析中,研究人员观察到,那些TP53功能丧失的患者在接受CDK4/6抑制剂治疗后,难以实现持久的细胞周期停滞状态;相比之下,TP53野生型的患者则能够维持较低的细胞增殖活性。这一观察结果不仅与先前的研究发现相吻合,而且进一步强化了TP53状态在决定CDK4/6抑制剂治疗效果中的关键作用,为临床上根据TP53状态来优化患者治疗方案提供了有力的证据支持。
研究小结
综上所述,本研究的结论着重强调了TP53基因状态在预测CDK4/6抑制剂长期疗效中的关键作用,并创新性地提出了联合应用CDK2抑制剂作为一种潜在的治疗策略,旨在增强p53缺失的HR+乳腺癌患者的治疗效果。这一突破性发现不仅为HR+乳腺癌的个体化治疗增添了新的分子标志物,也为开发新型联合治疗方案奠定了坚实的理论基础。未来,我们期待通过进一步的研究来验证这些重要发现,并积极探索如何将这些前沿知识转化为临床实践中的精准治疗策略。
通过这项深入细致的研究,我们不仅深化了对HR+乳腺癌治疗响应异质性的认识,还为未来的治疗开辟了新的视野。随着精准医疗领域的不断发展和进步,我们有理由相信,为每一位乳腺癌患者提供更加个性化、更加高效的治疗方案将成为可能,从而极大地改善患者的生活质量,延长生存期。
参考文献
1、Kudo R, Safonov A, Jones C, et al. Long-term breast cancer response to CDK4/6 inhibition defined by TP53-mediated geroconversion. Cancer Cell. 2024 Nov 11;42(11):1919-1935.e9. Cancer Cell. 2024 Nov 11;42(11):1983. DOI: 10.1016/j.ccell.2024.10.013.